基础医学院陈萍教授团队《Mol Cell》揭示FOXA1通过形成生物分子凝聚体行使先锋功能的分子机制
近日,首都医科大学基础医学院陈萍教授团队与清华大学王亮博士在《Molecular Cell》上发表题为“FOXA1 Forms Biomolecular Condensates that Unpack Condensed Chromatin to Function as a Pioneer Factor”的研究论文。该研究揭示FOXA1通过N端和C端的固有无序结构域(intrinsically disordered regions, IDRs)形成生物分子凝聚体,破坏紧密染色质结构,从而在调控基因转录、抑制乳腺癌发展过程中发挥重要作用。首都医科大学基础医学院博士生纪登玉、邵常荣博士和中国科学院生物物理研究所于娟副研究员为该论文的共同第一作者,首都医科大学基础医学院陈萍教授(末位通讯)和清华大学生命科学学院王亮博士为共同通讯作者。

在真核生物中,基因组DNA在细胞核内被包装形成染色质,限制转录因子结合靶标DNA。FOXA1,作为最早发现的先锋转录因子,能够直接与染色质结合,打开紧密染色质结构,协助其它转录因子包括雌激素受体ER和雄激素受体AR等的结合,在基因转录调控中发挥重要作用。研究发现FOXA1的突变是雌激素受体阳性(ER+)乳腺癌和前列腺癌的标志分子之一,调控相关癌症的发生、发展、转移、耐药等过程。但是FOXA1如何与染色质结合,并调控紧密染色质结构的机制仍然并不清楚。
该研究发现FOXA1在细胞内能够形成生物分子凝聚体,并破坏紧密异染色质结构;它的N端和C端IDRs是决定FOXA1形成凝聚体和打开紧密染色质能力的关键因素。有趣的是,尽管其DNA结合结构域FH本身没有形成凝聚体的能力,但是FH结合染色质的能力对FOXA1形成凝聚体和打开染色质极为重要。抑制FH结合DNA的乳腺癌相关疾病点突变显著降低了FOXA1形成生物分子凝聚体以及破坏异染色质的能力。体外纯化体系研究发现,连接组蛋白H1可以促进FOXA1与染色质结合,并且FOXA1的结合可以打开H1介导的紧密染色质结构,并溶解H1介导的染色质相分离液滴。截除N-和C-IDRs虽然不影响FOXA1与H1-染色质的结合,却使FOXA1丧失了破坏紧密染色质结构和染色质相分离液滴的能力,进一步证实了FOXA1的IDRs及其介导形成生物分子凝聚体的能力是FOXA1发挥先锋功能的关键因素。在乳腺癌细胞模型中,全基因组测序分析也证实了这一点。与FH结合的染色质区域相比,具有IDRs的全长FOXA1能够结合更紧密的染色质区域,并且其结合后的染色质区域具有更高的开放程度,从而激活了抑制乳腺癌细胞增殖和迁移相关基因的表达,在乳腺癌的发生发展中发挥功能。该研究揭示了FOXA1通过其N端和C端的IDRs形成生物分子凝聚体破坏紧密染色质结构,进而在基因转录调控中发挥先锋转录因子功能的新机制,并为FOXA1相关突变在乳腺癌中的功能研究提供新的理解。
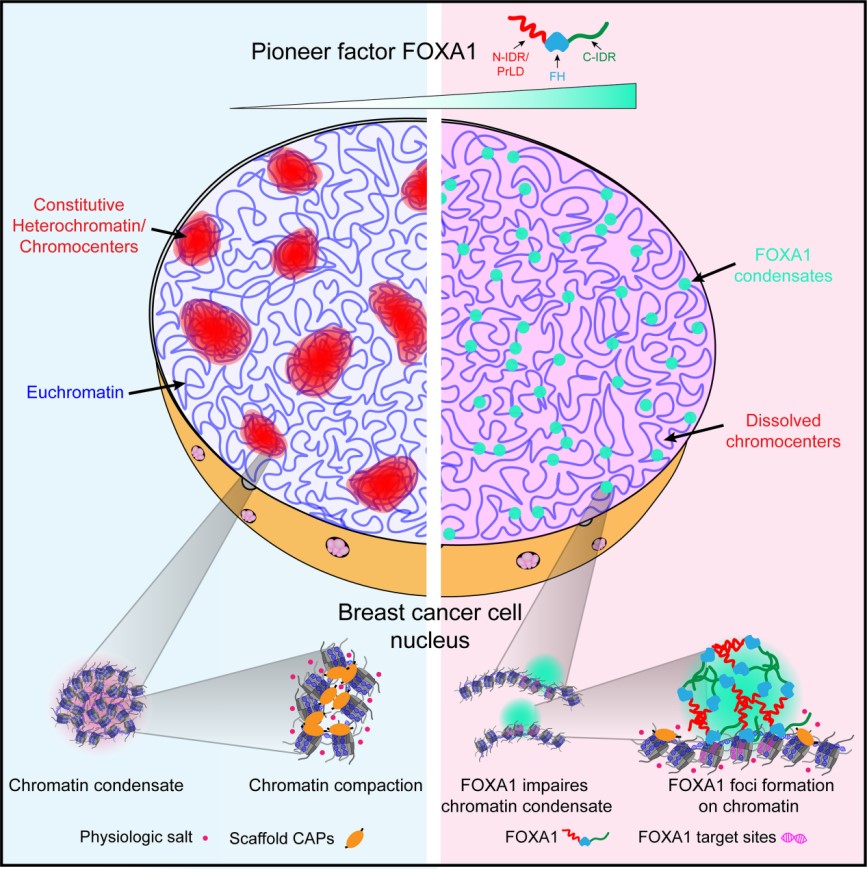
图 FOXA1通过形成生物分子凝聚体行使先锋功能的分子机制
该研究受国家自然科学基金(32022014、32100417)和国家重点研发计划(2022YFA0912400、2018YFE0203302)的资助。

陈萍,首都医科大学基础医学院教授,博士生导师。主要从事染色质表观遗传调控及其异常导致相关疾病的机制研究,在《Science》、《MolCell》、《JACS》、《NAR》等国际知名期刊发表论文30余篇,先后主持国家自然科学基金委优秀青年、面上、青年基金项目,科技部国际重大合作项目、中科院“卓越青年科学家”项目和北京市高层次留学人才回国资助等。
撰稿:陈萍
审核:张晨
