基础医学院李长龙副教授团队《Gastric Cancer》揭示幽门螺杆菌通过TLR6通路诱导宿主免疫耐受机制
近日,首都医科大学基础医学院李长龙副教授团队在《Gastric Cancer》上发表题为“Sustained exposure toHelicobacter pylori induces immune tolerance bydesensitizing TLR6” 的研究论文。该研究揭示了幽门螺杆菌(Hp)持续感染过程中,通过调控宿主胃上皮细胞TLR6/JNK信号通路抑制IL-8分泌,减少中性粒细胞募集从而实现免疫逃逸的机制。该发现为Hp的清除治疗提供了新的策略。首都医科大学基础医学院章秀林博士为该论文的第一作者,李长龙副教授为通讯作者。

Hp是最早被发现能在人类胃内寄生的微生物,已感染了超过50%的人类。Hp与胃炎和胃癌等疾病密切相关,被世界卫生组织定为一类致癌物。Hp感染胃上皮后,会诱发持续的炎症反应并导致细胞增殖和DNA复制错误的增加,进而促进肿瘤发生。胃上皮细胞是固有免疫反应的第一道防御屏障,其表面Toll样受体(TLRs)对微生物成分敏感。Hp在长期感染过程中通过干扰免疫应答来逃避宿主免疫系统的清除。TLRs已被证实在微生物病原体诱导的免疫耐受中起到关键作用,但Hp通过TLR信号通路诱导免疫耐受的具体机制尚不清楚。
该研究将胃上皮细胞GES-1与Hp和Hp裂解液进行持续30代的共培养,以模拟体内感染情况。同时构建感染Hp 90周的长爪沙鼠动物模型。动态追踪GES-1细胞和长爪沙鼠在Hp感染过程中TLRs通路及炎症因子表达变化。结果发现,Hp的急性感染能迅速激活TLR6炎症通路。在Hp的慢性感染期,TLR6对细菌成分敏感性降低,IL-1β、IL-8等表达被抑制。在慢性感染期激活TLR6/JNK信号通路可增强胃上皮IL-8表达,从而促进中性粒细胞募集,减少Hp在长爪沙鼠胃黏膜的定植。结果表明,TLR6可能成为Hp清除治疗的潜在靶点。
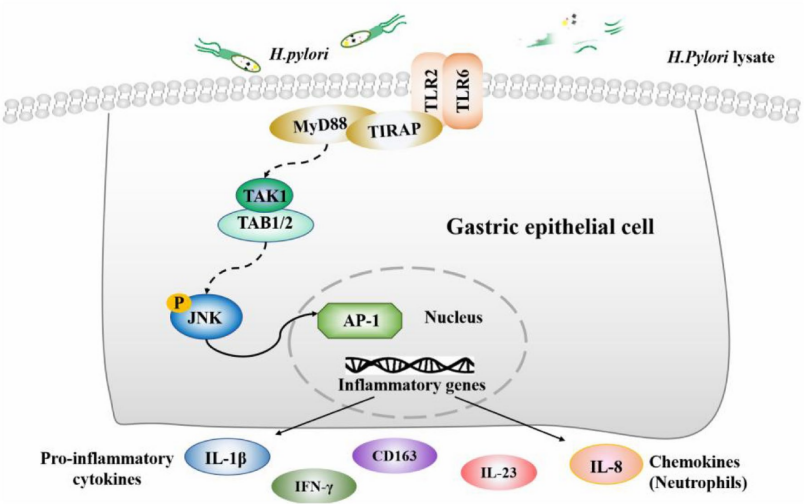
幽门螺杆菌通过TLR6/JNK信号通路上调促炎因子表达的机制
该研究受国家自然科学基金(332070537)、北京市教委重点项目(KZ20210025037)和科技部重点研发项目(2022YFF0711005)的资助。

李长龙,首都医科大学基础医学院医学遗传学与发育生物学学系副教授,硕士生导师。长期从事实验动物疾病模型及幽门螺杆菌感染致胃癌的机制研究。近5年主持国家自然科学基金2项、科技部重点研发计划子课题1项、北京科委重大专项课题1项、北京教委重点课题1项,发表论文20余篇,参编北京市地方标准6项、专著2部。
撰稿:李长龙
审核:张晨
